【考纲】2008年化学高考大纲:考察综合分析能力
分享至好友和朋友圈
蔡中华 中学化学高级教师,天星教育《试题调研》特约专家。长期战斗在教学一线,具有15年的高三教学经验,编著教学、教辅资料多部,精于原创题研究及高考研究。
1.观察能力
解读:
【例题1】2008 年北京奥运会主体育场的外形好似“鸟巢” ( The Bird Nest )。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除 B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是
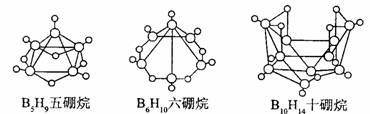
A.这类巢式硼烷的通式是 C nH n + 4
B.2B5H9 + 12O2 5B2O3 十9H2O ,l molB5H9
C.8 个硼原子的巢式棚烷化学式应为 B8H10
D.硼烷与水反应是非氧化还原反应
【解题指导】由这三个硼烷的分子式可知公差为 BH,所以通式为BnHn+4 ( n >1的整数),所以 A 正确 C 错误;根据B5H9燃烧反应方程式可求出l molB5H9完全燃烧转移24mol电子。本题通过“读”和“观”获取新的信息来分析回答相关问题。观察情景新型别致,首先通过观察一类硼烷的结构和分子式,找出它们存在的规律,求出其相应通式,继而分析出选项A、C正误。其次通过阅读得出选项B、D的正误。对于基础差,观察能力弱的考生可谓是无从下手,但命题又没有超出大纲所规定的能力范畴,体现了观察能力在解答实际问题中的重要作用,值得同学们领悟和赏析。答案:A
2.实验能力
解读:
【例题2】A盐是一种带有结晶水的淡蓝绿色晶体,溶于水后可电离出三种离子。用A盐进行以下实验:
① 准确称量3.920gA溶于适量的稀硫酸中,配成100mL淡绿色溶液,无其它现象。
② 取此溶液20.00mL加入足量浓NaOH溶液,加热,生成的气体恰好被20mL
0.10mol/LH2SO4完全吸收(生成正盐)。
③ 另取出20.00mL此溶液于锥形瓶中,用0.02mol/LKMnO4溶液滴定
(不需用指示剂),当到达终点时,用去KMnO4溶液20.00mL。
④ 再取20.00mL此溶液,加入足量BaCl2溶液,将生成的沉淀过滤、洗涤、烘干,经称量质量为1.00g。
⑤ 将3.920g晶体中的阴离子全部转化成钡盐,得钡盐4.66g。
试回答下列有关问题:
(1)在①中,不把A盐直接溶于水的主要原因是 。
(2)写出步骤②中的化学方程式,其中,可用离子方程式表示的要求用离子方程式表示 。
(3)A盐的化学式为 。
(4)为求得A盐的化学式,以上的实验步骤中,哪些步骤不需要并且是错误的
(填编号) ;错误的原因是 。
答案:(1)A可能含有Fe2+,为抑制该离子的水解,故加入适量稀H2SO4
(2)NH4+ + OH—=NH3↑+ H2O Fe2+ + 2OH—=Fe(OH)2↓ 4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3 NH3 + H+=NH4+ (3)(NH4)2Fe(SO4)2·6H2O
(4)④ 如果用步骤④的数据进行计算,由于得到的硫酸钡有一部分来自稀硫酸,将导致计算结果有误差
本题将定性、定量实验和化学基本实验操作融合起来,注重考查学生基本实验能力和分析实验数据的能力,特别是在理科综合中,在淡化复杂计算的同时,将计算和实验相结合是2008年高考的一大趋势之一,为此应引起我们的高度关注。
3.思维能力
解读:思维能力它包括思维的敏捷性(灵活性、针对性、适应性),思维的严密性(科学性、精确性、逻辑性和深刻性),思维的整体性(广阔性、综合性)及思维的创造性等,它是各种能力的核心。因此在高考中一直处于极为重要的位置,体现如下命题思想:①对中学化学基本知识内容能融会贯通,通过整理使之网络化,有序贮存,并正确复述、再现和辨认能力,通过考生的思考而最终获得正确结果。②能将实际问题(或题设情境)分解,联系所学知识迁移、转换、重组,使得问题得到解决,并能用恰当的语言、文字、反应式或图表表达出来的应用能力。③题目设置一些陷阱,如过程情景复杂化,但回答问题简单化,注重对过程分析的同时,更强调思维的灵活性和敏捷性考查。
【例题3】现有CuO和Fe2O3组成的混合物a g,向其中加入4.0 mol·L-1硫酸溶液25 mL时恰好完全反应。若将a g原混合物在足量CO中加热,使其充分反应,冷却后剩余固体质量为
A.1.6 g B.1.6a g C.(a-0.8) g D.(a-1.6) g
【解题指导】本题主要通过反应过程的分析考查学生的思维品质,如不注重反应本质的理解,思维能力差就会进入题设圈套中而无法求解。高考命题中一般的试题看起来简单,但实际上都是一种能力考查的体现,稍有不注意就会导致错误结果,为此在复习时注意思维能力的培养是极为重要的,
CuO和Fe2O3与硫酸反应的时,氧化物中所有的氧与稀硫酸的氢转化为H2O,而用CO还原 CuO和Fe2O3转化为CO2,二者失去O元素的质量是相等的。即H2SO4~H2O~O,n(H2SO4)=n(O)=0.025L× 4.0mol·L-1=0.1mol,O元素的质量为1.6g,故反应后深入固体质量=(a-1.6)g。答案:D
4.自学能力
解读:自学能力是要求考生敏捷地接受新的信息,联系已学过的知识,通过分析、判断,去伪存真,解决新的化学问题。信息包括学生通过日常生活获取的已有经验和在课堂上获取的已有知识,也包括试题的题干中现场提供的新信息,考查考生将这些信息进行整合、分析、提取有用内容点解答试题的能力,能够从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力。在高考命题中一般与研究性问题或无机、有机信息题联姻,形成新旧知识相交融来考查学生知识迁移能力。
【例题3】某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
【实验1】
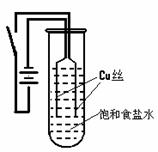
【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
|
序号 |
操作 |
现象 |
|
① |
滴入稀硝酸溶液 |
沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
|
② |
滴入稀硫酸溶液 |
橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
阅读资料:常见铜的化合物颜色如下:
|
物质 |
颜色 |
物质 |
颜色 |
|
氯化铜 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
氢氧化亚铜 (不稳定) |
橙黄色 |
|
碱式氯化铜 |
绿色 |
氢氧化铜 |
蓝色 |
|
氧化亚铜 |
砖红色或橙黄色 |
氯化亚铜 |
白色 |
|
溶度积常数/25℃ |
一定温度下,难溶强电解质饱和溶液中离子浓度的系数次方之积为一常数,该常数称为溶度积常,用Ksp表示,Ksp越大则难溶电解质在溶液中溶解趋势越大,反之越小。几种难溶物的Ksp如下: 氯化亚铜:1.2×10-6 氢氧化亚铜:1.4 10-15 氢氧化铜:1.6×10-19 | ||
请回答下列问题:
(1)铜的常见正化合价为___ _、_______,最终试管底部橙黄色沉淀的化学式_______________。
(2)阴极上产生气体所发生的反应为: ;阳极上附近出现白色混浊所发生的反应为: 。
(3)写出实验2中①、②的离子方程式
①___________________________,②____________________________________。
答案:(1)+1、+2 ; Cu2O
(2)阴极:2H++2e-=H2↑ 或2H2O+2e-=H2↑+2OH-
阳极:Cu+Cl--e-=CuCl↓;
(3)①3Cu2O + 14H+ + 2NO3-=6Cu2+ + 2NO↑ + 7H2O ;
②Cu2O + 2H+ = Cu + Cu2+ + H2O


 京公网安备11010202009747号
京公网安备11010202009747号
