[化学]辽宁名师:选择题6个知识块 实验考点有8个
分享至好友和朋友圈
丛丽萍老师为辽宁省实验中学化学组教研组长、教育学硕士、高级教师。
丛丽萍
如何抓好这剩下的宝贵复习时间,使化学的考前复习达到最佳效果?现就笔者在高三的教学实践中总结出的一些个人体会呈现给大家。
一、梳理整合
对知识进行梳理、归类、比较、整合,找出学科内各部分知识之间的联系,并将内容分专题整合成知识网络,形成知识板块,构建知识体系。从而学会对复杂问题进行分解,学会对简单问题进行组合,提高对知识的应变能力、迁移能力和衍生能力。具体做法举例如下:
1.细致研读《考试说明》,按照考试说明的要求展开主线复习。
考试说明(即考纲)是高考的依据,是化学复习的“总纲”,不仅要读,而且要深入研究,以便明确高考的命题指导思想、考查内容、试题类型、深难度和比例以及考查能力的层次要求等。
有了第一轮复习的基础,再加以考试说明的宏观把握,应该明确目标和方向,恰当地投入。比如对于元素化合物部分的复习,应该抓住典型、带动其他的主线复习,就可以达到事半功倍的效果。中学化学集中学习了氢、氧、硫、氯、氮、磷、碳、硅、钠、镁、铝、铁等元素,在非金属元素中,以硫、氮的知识较为复杂,在金属元素中,铝具有两性特点,铁的变价很有代表性,复习时要依照《考试说明》的要求重点抓好以氯、硫、氮为代表的非金属元素,以钠、铝、铁为代表的金属元素及其化合物,以化学理论为指导,紧密结合化学实验,就能较好地掌握全部元素化合物知识。
在元素化合物知识的复习中,各个知识点应以元素的单质及其重要化合物的化学性质为重点。这是因为物质的性质反映物质的结构,决定物质的用途、制法、检验、存在、保存等。在形成知识主线的基础上,重点放在结合化学理论复习典型元素化合物,并以此带动全局知识的复习,掌握复习方法,培养自学能力。这样更有利于解决高考中守纲不守本的新信息题,有利于发挥迁移能力,预测未知元素的性质。
2.梳理近几年的高考试题,整合各个专题的常考热点。
比如对于实验专题的复习历来都是学生感到烦琐和不自信的地方,我们不妨在进行第二轮复习的时候直面历届高考化学试题,总结归纳这其中的必考点加以强化复习,就会让我们有明确的方向和必胜的信心了。实验部分常常涉及的考点一般有以下8个方面:
①仪器的排列组合。根据实验的原理选择仪器和试剂,根据实验的目的决定仪器的排列组装顺序,一般遵循气体制取→除杂(若干装置)→干燥→主体实验→实验产品的保护与尾气处理。
②接口的连接。一般应遵循装置的排列顺序。对于吸收装置,若为洗气瓶则应“长”进(利于杂质的充分吸收)“短”出(利于气体导出),若为盛有碱石灰的干燥管吸收水分和CO2,则应“大”进(同样利用CO2和水蒸气的充分吸收)“小”出(利于余气的导出),若为排水量气时应“短”进“长”出,排出水的体积即为生成气体的体积。
③气密性检查。凡有制气装置都存在气密性检查问题。关键是何时进行气密性检查?如何进行气密性检查?显然应在仪器连接完之后,添加药品之前进行气密性检查。气密性检查的方法虽多种多样,但总的原则是堵死一头,另一头通过导管插入水中,再微热(用掌心或酒精灯)容积较大的玻璃容器,若水中有气泡逸出,停止加热后导管中有一段水柱上升则表示气密性良好,否则须重新组装与调试。
④防倒吸。
⑤事故处理。
⑥实验方案的评价。对实验方案的评价应遵循以下原则:a.能否达到目的;b.所用原料是否常见易得、廉价;c.原料的利用率高低;d.过程是否简捷优化;e.有无对环境污染;f.实验的误差大小有无创意等等。
⑦实验设计。实验设计属于一种较高层次的能力考查,它分为实验原理设计和实验操作程序设计。最优方案的设计应遵循上述实验方案评价的六原则。
⑧实验结果的分析。一般从以下四方面考虑:a.方案是否合理,这是决定实验成败的关键;b.操作不当引起的误差;c.反应条件不足可导致反应不能发生或反应速率过慢引起实验误差;d.所用试剂不纯,杂质甚至参与反应均可导致实验误差等等。
二、智慧提升
在第二轮梳理整合的基础上,我们要进行第三阶段的智慧提升阶段——即专项题型解题能力的全面提升。举例说明如下:
1.选择题部分。
纵观每一年的高考理综合试卷中的化学部分,8道选择题覆盖6个知识块(概念、理论、元素化合物、有机、实验、计算),有些知识块会出两个选择题,比如概念部分和理论部分。所以进行选题练题和分析总结的时候一定要把试题的出处和考点落实清楚。如:
例1 运用元素周期律分析下面的推断,其中错误的是( )
①铍(Be)的氧化物的水化物可能具有两性
②铊(Tl)既能与盐酸作用产生氢气,又能跟NaOH溶液反应放出氢气,Tl(NO3)3溶液的酸性很强
③砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸
④锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤硫酸锶(SrSO4)是难溶于水的白色固体
⑥硒化氢(H2Se)是无色、有毒,稳定的气体
A.①③⑤ B.①②④⑥
C.②④⑥ D.①②③④⑤⑥
[答案] C
[解析]Be处于金属与非金属分界线附近,与Al存在相似性,所以其氧化物、氢氧化物具有两性,①项正确;Tl在Al之后,金属性比Al强,不具有两性,②项错;由F2-Cl2-Br2-I2-At2单质、氢化物性质的递变规律,At2颜色很深,氢化物HAt不稳定,如同AgI一样感光性很强,不溶于水和稀酸,③项正确;Li与Mg处于周期表中对角线位置,性质相似,与O2反应生成Li2O,LiOH为中强碱,④项错;由MgSO4、CaSO4、BaSO4溶解性递变规律,SrSO4为沉淀,⑤项正确;H2Se的稳定性比H2S的差,为不稳定气体,⑥项错。因此应选C。
例2 从化学角度来看,下列实验操作与事故处理不正确的是( )
A.在250ml烧杯中加入216mlH2O和24g固体NaOH,配制浓度为10%的NaOH溶液
B.在用二氧化锰和浓盐酸反应制取氯气的实验过程中,加入二氧化锰后,应先注入浓盐酸,然后再加热制取氯气
C.在用固体氯化铵和氢氧化钙制取氨气结束后,将大试管从铁架台上取下置于石棉网上冷却后洗涤
D.当液氯罐破损时,为防止液氯泄漏,应立即将罐置于碱水池中进行处理
[答案] A
[解析]本题涉及化学实验的基本操作、实验过程中的有关安全问题。对于A项,所装溶液太多,搅拌会使溶液溅出。B、C项都是为了预防温度的急剧变化而引起玻璃制品的破裂,均正确。对于D项,液氯与碱水发生化学反应,故处理方法正确。
例3对于平衡体系mA(g) +n B(g) →pC(g) +qD(g);△H<0。下列结论中正确的是( )
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若往含有a mol气体的平衡体系中再加入b molB,达到新平衡时,气体的总物质的量一定小于(a+b)
D.温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
[答案] B
[解析] 温度不变,体积扩大1倍,A的浓度为原来的0.48倍,说明平衡正向移动,则m+n
例4 诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类物质,其结构简式如右图所示,下列有关诺龙性质的说法中,正确的是( )
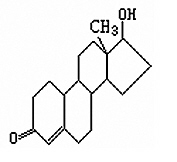
A.所有碳原子都在同一平面内
B.用新制的氢氧化铜悬浊液可将
诺龙和乙醛鉴别开来
C.能发生取代、消去、
加成、酯化、水解等反应
D.诺龙的分子式
为C18H23O2
[答案] B
[解析] 本题主要考查有机化学基础,涉及到的主要知识点有结构、官能团的性质、反应类型、分子式等几个方面。有机物主要是含环烷烃环,故碳原子不在同一平面,A错;分子式为C18H25O2,B错;不能发生水解反应,C错;不含醛基,故B正确。
2.主观题部分。一般后面的主观卷部分会有四道化学的大题,每题分值15分左右,考查内容依然涉及六大知识块。通常会有一个无机推断,一个有机推断,一个化学实验,一个综合概念和理论、计算的有关填空题。对于这部分内容更要拨开面纱,找出其真正的考查基点,就会使解题变得轻松而又愉快。
例如:A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件均未列出)。
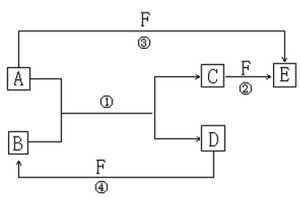
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则物质B的名称是 ,晶体B内部的微粒及微粒间的作用分别是 。
(2)若A是常见金属单质,D、F是气体单质,反应①在水溶液中进行,则单质A是 ,反应②(在水溶液中进行)的离子反应方程式是 ;已知D与F反应生成1mol B时放出92.3kJ的热量,写出该反应的热化学方程式 。
(3)若A、D为短周期元素所组成的单质,且所含元素的原子序数A是D的两倍,原子核最外层电子数D是A的两倍,③、④两个反应都有红棕色气体生成,则反应①、④的化学方程式分别为 ① ;
④ 。
[解析]本题是对有关常见元素的单质及重要化合物的知识比较全面和综合的考查。这种题型在理综合的高考试题中已经成为相对稳定的必考题,即我们通常所说的无机推断题。跟辽宁省2006年的理综合试卷中出现的写三个置换反应的题目有相似之处,即在限定的范围内对元素的单质及化合物进行筛选和验证,要求学生具有比较扎实的基础掌握,试题覆盖面较大,有很好的区分度。这种推断题的突破口不像传统的推断题,可以在题干信息中或是框图中找到,这个题目的突破需要在下面的每一个问题当中来寻找。比如解决第一个问题,通过限定A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,可以筛选出A、D、F应该在C、N、O、F、Si、P、S、Cl这几种常见的非金属元素中来选择确定,再去结合框图,会看到A能置换出D(说明A排在D的上面,符合要求的有两组:C、Si;O2、S。)且A+F→E,C+F→E,可得A在C和E中有变价,符合要求的只有C、Si、O这三种单质,推到此,其他问题就可以迎刃而解了。
[本题答案](1)二氧化硅 硅原子和氧原子 共价键
(2)Fe 2Fe2++Cl2 2Fe3++2Cl-
H2(g)+Cl2(g) 2HCl(g);
ΔH=-184.6kJ·omol-1
(3)2Mg+CO2 2MgO+C
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
由于篇幅所限,我只能略举以上几个典型例题,目的是让广大考生明确自己复习的方向和依据,训练自己思考问题的视角和技巧,这样才能真正跳出题海,脱离苦海,才能达到考前复习的最大化效果。最后衷心祝愿每一位2007届的高考考生都能考出自己的实力,实现自己理想的目标!


 京公网安备11010202009747号
京公网安备11010202009747号
